
L'angolo del dottorino
Indice
Cerca nel sito... Ricerca avanzata

La terapia ormonale (ormonoterapia) nei tumori
Gli ormoni sono prodotti dal sistema endocrino ed esplicano il loro effetto sul sistema endocrino stesso che si autoregola con meccanismi di feedback e sugli altri organi e tessuti interagendo con dei recettori che attivano cascate intracellulari (tirosin chinasi) di segnali che conducono alla trascrizione del DNA.
La terapia ormonale in oncologia è applicabile ai tumori endocrini (che verranno trattati nella sezione di endocrinologia ancora non presente su questo sito ma prima o poi la facciamo) e nei tumori di altri organi e tessuti la cui attività è fortemente dipendente dagli ormoni come ad esempio mammella e prostata (che saranno oggetto di questa trattazione).
Nel corpo umano ci sono dei tessuti le cui cellule fisiologicamente proliferano sotto stimolo ormonale. Basti pensare alle modificazioni del seno con il ciclo mestruale ed in gravidanza …
Le neoplasie che derivano da trasformazione neoplastica di queste cellule spesso conservano i recettori ormonali e proliferano sotto stimolo ormonale e quindi togliendogli lo stimolo ormonale gli andiamo a stoppare la proliferazione.
Requisito essenziale della sensibilità agli ormoni è la presenza sulle cellule dei recettori per gli ormoni e l’integrità delle cascate intracellulari proliferative accoppiate a tali recettori.
Il razionale dell’ormonoterapia è quello di intervenire sulla proliferazione delle cellule neoplastiche ormonosensibili bloccando gli ormoni e/o i recettori ormonali e/o le loro vie intracellulari e dalla cui presenza è fortemente dipendente la proliferazione.
La terapia ormonale rispetto alla chemioterapia non ha gli effetti collaterali classici quali nausea, vomito alopecia, mielodepressione etc. ma può avere effetti avversi correlati all’eccesso o al difetto degli ormoni.
Mammella e prostata sono i tumori non endocrini che meglio si avvantaggiano della terapia endocrina.
Nella mammella si interviene sulla via estrogestinica, nella prostata su quella androgenica.
In questa pagina saranno presentati i principali farmaci utilizzati per questi scopi; gli schemi terapeutici e le associazioni con altre terapie saranno trattata nelle pagine relative al cancro della mammella e al cancro della prostata.
Gli ormoni della mammella per essere sensibili alla terapia ormonale devono esprimere sulla loro superficie recettori ormonali. Fortunatamente il 70% del cancri mammari esprime tali recettori … ma il 30% no! Per cui prima di intraprendere la terapia ormonale è necessario accertare la presenza di tali recettori (ce lo dice il patologo dopo istologico su biopsia).
Nella mammella possiamo intervenire direttamente sui recettori, a livello ipofisario (l’ipofisi produce LH che stimola l’ovaio a produrre estrogeni) o a livello periferico intervenendo sulla trasformazione degli androgeni in estrogeni.
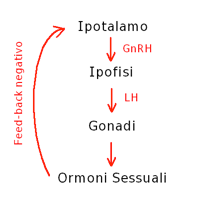
Schema Asse Ipotalamo-Ipofisi
Il tamoxifene è un antiestrogeno parziale che interagisce con i recettori per gli estrogeni ma ha effetti differenti a secondo del tessuto in cui arriva.
A livello dalla mammella ha un effetto antiestrogestinico e va a bloccare il recettore ottenendo lo scopo che ci prefiggiamo nella terapia oncologia.
A livello di osso ed utero ha però un effetto estrogestinico e può avere come effetto collaterale ipertrofia endometriale (fino a neoplasia) ed osteoporosi.
Il Fulvestrant è invece un antiestrogeno puro che ha effetti inibitori universali e determina down-regulation su tutte le cellule di tutti i tessuti che esprimono recettori per gli estrogeni.
Gli antiandrogeni (proprionato, emanato di testosterone, floximestrone) hanno comportamento simile agli antiestrogeni, vengono utilizzati a dose massicce ed hanno effetti collaterali pesanti, vengono per tanto utilizzati poco preferendo abolire le vie androginiche in altri punti chiave come ad esempio la produzione di ormoni gonadotropici.
Gli analoghi del LHRH (buserelin goserelin leuprolide) sono dei farmaci simili al GnRH.
Il GnRh stimola fisiologicamente l’ipofisi alla produzione di LH.
Gli analoghi del LHRH sono dei super agonisti che si sostituiscono al GnRH e causano una down regulation dei recettori ipofisari del GnRH impedendo all’ipofisi a produrre LH.
LH nella donna stimola l’ovaio a produrre estrogeni e nell’uomo le cellule interstiziali del testicolo a produrre testosterone. Per tanto gli analoghi del LH riducono l’attività degli estrogeni nella donna e degli androgeni nell’uomo.
Effetti collaterali degli LHRH sono diminuzione della libido, vampate di calore ed impotenza. Gli effetti collaterali sono di norma più evidenti nella donna.
Un altro effetto collaterale è il flare-up: inizialmente, poiché gli LHRH sono superagonisti, determinano un incremento della produzione di LH con aumento della massa tumorale e poi per attivazione di meccanismi di feedback negativo causano la riduzione dei recettori e blocco del LH.
Gli analoghi del LH si usano sia nel carcinoma mammario che in quello prostatico.
Relativamente al carcinoma mammario va fatta una precisazione: la riduzione di LH determina uno spegnimento dell’ovaio che non produce più estrogeni inducendo una menopausa farmacologica. Nelle donne in menopausa dove l’ovaio è già spento e non produce già di suo estrogeni non ha senso abolire LH!!!
In periodo post-menopausale la principale fonte è la trasformazione nei tessuti periferici (es. tessuto adiposo) di testosterone (di origine surrenalinica) in estradiolo. Enzima chiave della trasformazione degli androgeni in estrogeni è l’enzima aromatisi. Possiamo per tanto andare ad inibire l’enzima aromatasi utilizzando dei farmaci che si chiamano inibitori delle aromatasi. Tra gli inibitori delle aromatasi abbiamo letrozono, anastrazolo ed exemestane. Letrozolo ed anastrazolo sono delle molecole a struttura non steroidea che legano le aromatasi in modo reversibile mentre l’exemestane ha struttura steroidea e lega in modo irreversibile le aromatasi.
Altri farmaci di possibile utilizzo nel carcinoma mammario sono i progestinici (megestroloacetato e medrossi progesterone o MAP) che somministrati ad alte dosi riducono i livelli plasmatici di estradiolo, ne riducono l’affinità con il recettore e diminuiscono la produzione di androgeni da surrene (che è la principale fonte di estrogeni in post menopausa.